Theo thông tin từ Cục Quản lý Dược (Bộ Y tế), quyết định số 628/QĐ-QLD được ban hành ngày 31/10/2025 cho phép lưu hành 14 loại vaccine và sinh phẩm y tế mới tại Việt Nam, trong đó đáng chú ý nhất là thuốc Pembroria có hoạt chất chính Pembrolizumab, hàm lượng 100mg/4ml, do Công ty Limited Liability “PK-137” (Nga) sản xuất và một cơ sở tại Các Tiểu vương quốc Ả Rập Thống nhất đăng ký.
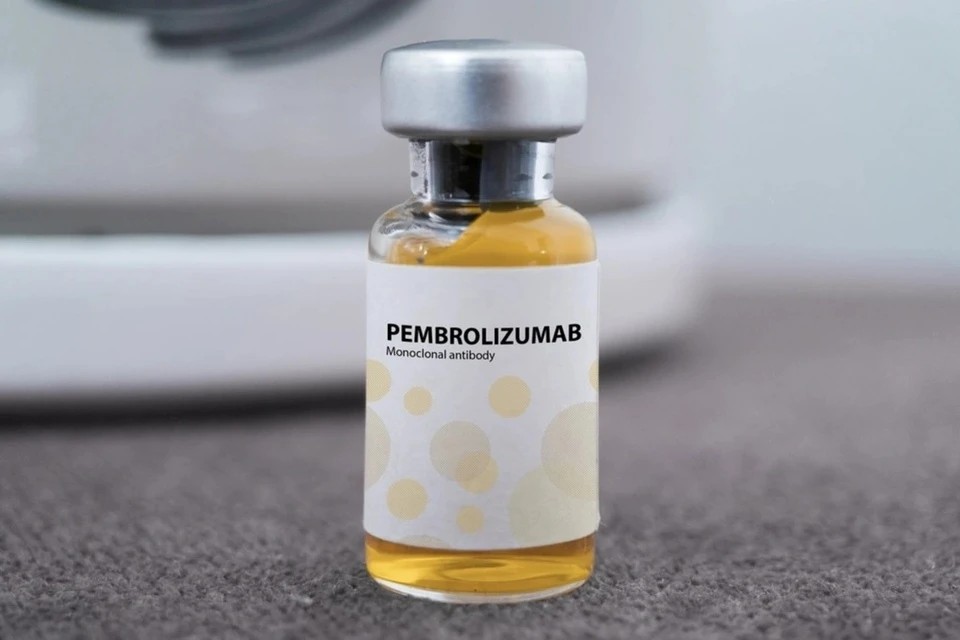 Thuốc Pembroria có hoạt chất chính là Pembrolizumab. Ảnh: Incentra.
Thuốc Pembroria có hoạt chất chính là Pembrolizumab. Ảnh: Incentra.Pembroria được bào chế dưới dạng dung dịch đậm đặc để pha tiêm truyền, có hạn sử dụng 24 tháng kể từ ngày sản xuất. Hoạt chất Pembrolizumab vốn đã được biết đến trên toàn cầu như một trong những liệu pháp miễn dịch tiên tiến nhất, với hơn 14 chỉ định cho nhiều loại ung thư khác nhau như:
- Ung thư biểu mô phổi không tế bào nhỏ
- U hắc tố ác tính
- Ung thư đại trực tràng
- Ung thư cổ tử cung
- Ung thư biểu mô tế bào thận
- Ung thư vú...
Cơ chế của Pembrolizumab giúp kích hoạt hệ miễn dịch tấn công tế bào ung thư, thay vì chỉ tiêu diệt trực tiếp như các thuốc hóa trị truyền thống. Việc thuốc được cấp phép lưu hành tại Việt Nam hứa hẹn tăng khả năng tiếp cận điều trị cho người bệnh, đặc biệt trong bối cảnh chi phí điều trị ung thư bằng thuốc nhập khẩu luôn là gánh nặng lớn.
Cục Quản lý Dược yêu cầu doanh nghiệp đăng ký phải báo cáo định kỳ 3 tháng/lần về tiến độ nghiên cứu lâm sàng pha III, đồng thời nộp bổ sung dữ liệu theo dõi tính sinh miễn dịch khi nghiên cứu kết thúc.
Tất cả thuốc được sản xuất và cung cấp tại Việt Nam đều phải tuân thủ hồ sơ đăng ký đã được phê duyệt, có số đăng ký do Bộ Y tế cấp in trên nhãn để đảm bảo minh bạch và truy xuất nguồn gốc. Nếu có bất kỳ thay đổi nào về sản phẩm hoặc quy trình sản xuất tại nước sở tại, cơ sở đăng ký phải báo cáo ngay cho Bộ Y tế.
Đặc biệt, việc duy trì tiêu chuẩn thực hành tốt sản xuất (GMP) của nhà máy sản xuất và cơ sở nguyên liệu là bắt buộc. Nếu cơ sở bị thu hồi giấy phép hoặc không đáp ứng tiêu chuẩn GMP, doanh nghiệp đăng ký thuốc phải thông báo trong vòng 15 ngày theo quy định tại Nghị định 163/2025/NĐ-CP.
Ngoài Pembroria, trong đợt này còn có 13 sản phẩm khác được cấp giấy đăng ký lưu hành như:
- Metalyse (Tenecteplase)
- Spevigo (Spesolimab)
- Remsima (Infliximab)
- Soliris (Eculizumab)
- Flumist (vaccine cúm sống giảm độc lực)
- Darzalex SC (Daratumumab)
- Ocrevus (Ocrelizumab)...
Đây đều là các thuốc và sinh phẩm điều trị bệnh lý nghiêm trọng như rối loạn miễn dịch, tim mạch, hoặc các bệnh mạn tính hiếm gặp, góp phần mở rộng danh mục thuốc đặc trị tại Việt Nam.
Việc thuốc ung thư của Nga chính thức lưu hành tại Việt Nam không chỉ giúp đa dạng hóa nguồn cung dược phẩm, mà còn thể hiện nỗ lực hội nhập và cập nhật Công nghệ điều trị hiện đại của ngành y tế Việt Nam.
Trang Đào